В современной химии существует множество различных классификаций химических реакций, основанных на изменении существенных свойств веществ участвующих в реакции: изменение степени окисления элементов, изменения в различный группах молекул и т.д. В этой статье я хочу предложить тип классификации, основанный не на конечном множестве различных типов реакций, а на иных принципах, которые по моему мнению, позволяют делать некоторые предположения об осуществимости и условиях реализации той или иной гипотетической или реальной химической реакции.
В настоящее время известно более ста миллионов различных химических веществ, большая часть из которых органические, а точное количество возможных химических реакций настолько велико, что исследовать их все лабораторным путем весьма трудоемкая задача.
Развития компьютерного моделирования во многих отраслях науки и в частности в химии, внедрение перспективных разработок из области искусственного интеллекта, нейронных сетей и машинного обучения позволяет значительно сократить требуемые объемы лабораторных исследований для решения той или иной задачи.
Что такое химический элемент? #денисмарков #химия #умскул
Предлагаемая классификация разрабатывается мной для применения в системах машинного обучения и на текущий момент может являться неполной и/или неточной.
Хочу также отметить, что я не являюсь экспертом в области химии, а лишь увлекаюсь данной наукой как хобби, поэтому возможен непреднамеренный плагиат и другие неточности. Изложенные идеи основаны исключительно на моем понимании химии, поэтому я всегда буду рад квалифицированным комментарии от знающих людей, по обсуждаемой здесь теме.
Итак, отправной точкой этого небольшого исследования будет тот общепризнанный факт, что структура молекулы имеет в химии первостепенное значение. Из чего состоит структура? С математической точки зрения, в общем случае это циклический граф, в вершинах которого находятся атомы, а ребра представлены химическими связями.

Химическая связь весьма интересный объект. По общим представлениям при образовании новой химической связи освобождается некоторое количество энергии, а для разрыва химической связи требуется примерно такое же количество энергии затратить.
В теории химическая реакции выглядит примерно следующим образом: есть реагент или реагенты, которые при определённых условиях (температура; давление; катализатор и т.д.) реагируют между собой и образуют продукт или продукты реакции.
Что происходит в процессе реакции? В общем случае я бы ответил на этот вопрос следующим образом: происходит структурное перераспределение существующих в продукте химических связей, а также образование новых связей и разрыв существующих.
Химическая реакции может выглядеть, например так:

Однако мы начнем с более простых примеров из неорганической химии, для понимания которых будет достаточно школьных знаний. В процессе рассмотрения примеров различных химических реакций я постараюсь объяснить суть предлагаемого метода классификации химических реакций.
Что такое ЩМЯГА в химии? | Екатерина Строганова #shorts #химия
Рассмотрим реакцию оксида натрия с водой
Обратим особое внимание на химические связи. Изучив схему реакции, можем сделать вывод о том, что химическая реакция не изменила общее количество и качество химических связей, а лишь распределила их между молекулами в другом порядке.
Можно привести большое количество примеров химических реакций, которые не меняют общее количество и качество химических связей, а лишь распределяют их между молекулами в другом порядке. Однако реакции с условно бесконечными цепями, типа полимеризации этилена или тетрафторэтилена к данному классу химических реакций причислять не следует, т.к. по аналогии с математикой фактор бесконечности весьма специфичен.
Определим этот класс реакций как распределительные и введем следующее обозначение класса: +0R0. Первое число указывает на общее изменение степени окисления всех атомов в процессе реакции +N или –N, второе обозначает количество реформированных исходных связей. Знак минус или плюс указывает на то, что реакция необратима, т.е. протекает только в одном направлении, для обратимых реакций знак указывать не будем.
Общепринято разделять данный класс реакций на три типа:
(I) реакция соединения;
(II) реакция разложения;
(III) реакция обмена.
Далее нам понадобятся некоторые справочные данные о степени окисления:
У всех простых веществ степень окисления равна нулю
Степень окисления кислорода в оксидах всегда равна -2, в соединениях типа перекиси водорода степень окисления кислорода -1 т.к. молекула содержит o-o связь.
Водород в соединении с металлами (в гидридах) проявляет степень окисления −1, а в соединениях с неметаллами, как правило, +1 (кроме $SiH_4, B_2H_6$). Алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю, а в сложном ионе — заряду этого иона.
Вооружившись новыми знаниями, рассмотрим реакцию горения метана

Из схемы реакции следует, что общее количество химических связей, как и в предыдущем примере не изменилось, однако все восемь исходных химических связей были преобразованы в процессе реакции. Степень окисления атома углерода изменилась с -4 до +4, и соответственно 4 атома кислорода изменили свою степень окисления с 0 на -2.
Согласно используемой классификации данную реакцию определим как +8R8. Обратную реакцию соответственно можно классифицировать как -8R8. Особо отметим тот факт, что для целей классификации, практическая осуществимость конкретной химической реакции не имеет существенного значения.
И ещё один простой пример

Также следует обратить внимание, что: Общее количество химических связей до и после реакции не изменяется, но это не точно. В Википедии данный факт объясняют следующим образом:
В химических реакциях должно выполняться правило сохранения алгебраической суммы степеней окисления всех атомов. Именно это правило делает понятие степени окисления столь важным в современной химии. Если в ходе химической реакции степень окисления атома повышается, говорят, что он окисляется, если же степень окисления атома понижается, говорят, что он восстанавливается. В полном уравнении химической реакции окислительные и восстановительные процессы должны точно компенсировать друг друга.
Например, реакции горения углерода и реакция термического разложения карбоната натрия без ошибок валентности должны выглядеть примерно так:

Однако, в реакция термического разложения Тетракарбонилникеля или Гексакарбонил хрома это правило нарушается:

В качестве небольшого отступления: реакция восстановления диоксида углерода до этилена, которую по неподтвержденным пока данным, научились осуществлять при использованием специального медного катализатора.

Реакцию можно классифицировать как -12R12 (реформированы все 12 исходных связей).
Возникает резонный вопрос: всегда ли количество реформированных связей равно по модулю изменению степени окисления? Совсем не обязательно. Например, в реакции гидролиза диэтилового эфира, реформируется только одна O-H связь в O-C связь, при этом степени окисления атомов не меняются.

Теперь рассмотрим самый важный вопрос: зачем нужна подобная классификация?
Как и любая другая классификация, для обобщения и определения некоторых специфических особенностей и закономерностей.
Одна из масштабных задач, создание компьютерной системы способной предугадывать продукты химических реакций, а также генерировать возможные реакции для синтеза достаточно сложных химических веществ.
Не будем делать грандиозных фундаментальных выводов, а сделаем пока лишь некоторые достаточно очевидные предположения, которые возможно подтвердить или опровергнуть только экспериментальным путем.
Среднестатистическая сложность реализации обратной реакции возрастает пропорционально росту N и R.
Другие предположения, которые можно обсудить в комментариях к данной статье.
На этом всё, если будут получены какие-либо подтвержденные результаты исследований, то я обязательно напишу продолжение данной статьи.
Источник: habr.com
Урок 9. Молярная масса и молярный объем
В уроке 9 «Молярная масса и молярный объем» из курса «Химия для чайников» выясним, что подразумевается под молярной массой и молярным объемом; приведем формулы для их вычисления. Напоминаю, что в прошлом уроке «Химическое количество вещества и моль» мы выяснили, что такое химическое количество вещества; рассмотрели моль в качестве единицы количества вещества, а также познакомились с постоянной Авогадро.

Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х) . Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
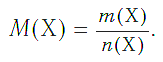
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
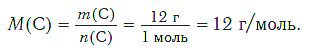
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
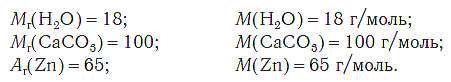
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.

Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
![]()
и, наоборот, химическое количество по массе:
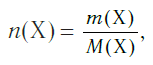
а также число структурных единиц:
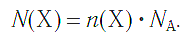
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm .
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х) :
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм 3 /моль. Другими словами, молярный объем любого газа при нормальных условиях:
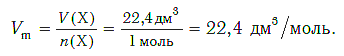
Молярный объем — это объем, равный 22,4 дм 3 , который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.

Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.

Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?

Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?

Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм 3 .
- Величина, равная 22,4 дм 3 /моль, называется молярным объемом газов.
Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
Источник: himi4ka.ru
Презентация Терминология и основные понятия в химии высокомолекулярных соеденений



















Вы можете ознакомиться и скачать презентацию на тему Терминология и основные понятия в химии высокомолекулярных соеденений. Доклад-сообщение содержит 20 слайдов. Презентации для любого класса можно скачать бесплатно. Если материал и наш сайт презентаций Mypresentation Вам понравились – поделитесь им с друзьями с помощью социальных кнопок и добавьте в закладки в своем браузере.
Слайды и текст этой презентации
Слайд 1

Описание слайда:
ТЕРМИНОЛОГИЯ И ОСНОВНЫЕ ПОНЯТИЯ В ХИМИИ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДЕНЕНИЙ
Слайд 2

Описание слайда:
Высокомолекулярные соединения – это химические соединения, молекулы которых состоят из большого числа повторяющихся (точно или приближенно) одинаковых звеньев, обладающих большой молекулярной массой и особыми свойствами. Химия ВМС изучает вещества, молекулы которых состоят из огромного числа атомов, соединенных между собой обычными ковалентными связями.
Такие молекулы называют макромолекулами, например макромолекулы полиэтилена (C2Н4)n, целлюлозы (С6Н10О5)n, натурального каучука (С5Н8)n, полихлорвинила (С2Н3Cl)n и другие. Высокомолекулярные соединения – это химические соединения, молекулы которых состоят из большого числа повторяющихся (точно или приближенно) одинаковых звеньев, обладающих большой молекулярной массой и особыми свойствами.
Химия ВМС изучает вещества, молекулы которых состоят из огромного числа атомов, соединенных между собой обычными ковалентными связями. Такие молекулы называют макромолекулами, например макромолекулы полиэтилена (C2Н4)n, целлюлозы (С6Н10О5)n, натурального каучука (С5Н8)n, полихлорвинила (С2Н3Cl)n и другие. Макромолекулы большинства полимеров построены из одинаковых, многократно повторяющихся групп атомов – элементарных (мономерных) звеньев, связанных между собой. Например: …−СН2−СН2−СН2−СН2–… полиэтилен …−СН2−СН−СН−СН2–… поливинилхлорид Cl Cl ВМС часто называют просто полимерами (poly – много, meros – часть).
Слайд 3

Описание слайда:
Число элементарных звеньев n в макромолекуле является одной из главных характеристик полимера. Между этой величиной и молекулярной массой полимера имеется следующее соотношение: n = М/m, где m – молекулярная масса элементарного звена.
Полимеры с высокой степенью полимеризации называют высокополимерами (М > 5000), с небольшой – олигомерами (степень полимеризации от единиц до нескольких сотен). Свойства олигомеров промежуточны между свойствами обычных низкомолекулярных веществ и «настоящих» ВМС, что и является критерием их выделения.
Число элементарных звеньев n в макромолекуле является одной из главных характеристик полимера. Между этой величиной и молекулярной массой полимера имеется следующее соотношение: n = М/m, где m – молекулярная масса элементарного звена. Полимеры с высокой степенью полимеризации называют высокополимерами (М > 5000), с небольшой – олигомерами (степень полимеризации от единиц до нескольких сотен). Свойства олигомеров промежуточны между свойствами обычных низкомолекулярных веществ и «настоящих» ВМС, что и является критерием их выделения.
Слайд 4

Описание слайда:
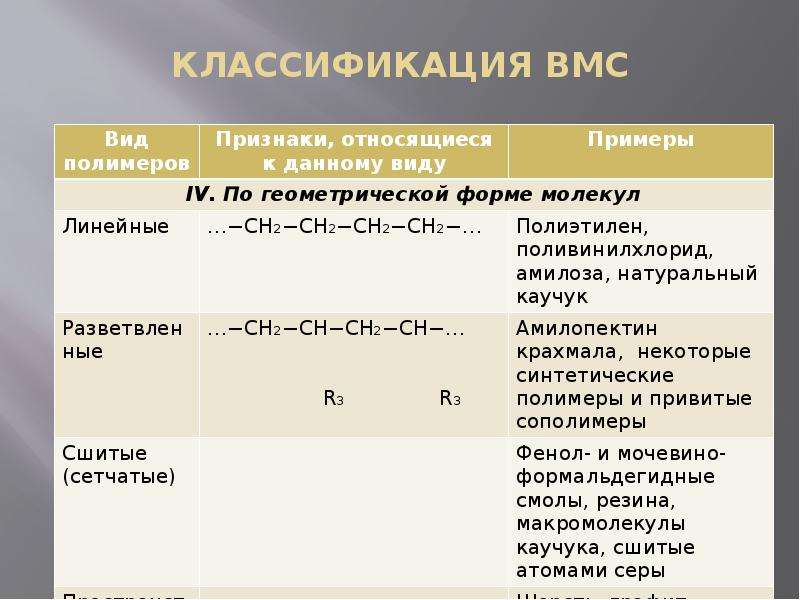
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА Многообразие полимерных соединений привело к созданию различных классификаций, в основу которых положены характерные свойства этих веществ. Обычно ВМС классифицируют по происхождению, составу, строению, структуре, отношению к нагреванию, методу синтеза, однородности звеньев (табл. 1). По химическому составу структурных звеньев различают несколько видов полимеров. Гомополимеры – все звенья одинаковые (−СН2−СН=СН−СН2−)n −А−А−А−А− Сополимеры – макромолекула содержит разные по составу или строению звенья. Они подразделяются на: 1. Чередующиеся, или тактические (линейные полимеры с регулярным расположением звеньев) …−А−В−А−В−А−В−… 2. Атактические (линейные полимеры с нерегулярным расположением звеньев) …−А−В−В−А−В−А−А−… 3. Блок-сополимеры (в линейной цепи содержатся блоки, состоящие из довольно большого числа одинаковых звеньев). …−А−А−А−В−В−В−А−А−А−В−В−В−… 4. Привитые (имеют разветвленное строение, основная цепь составлена из одних мономеров, а боковые ответвления – из других) −В−В−В−В−… …−А−А−А−А−А−А−А−… …−В−В−В−В−
Источник: mypresentation.ru