Водные растворы солей имеют разные значения pH, то есть показывают различную реакцию среды — кислую, нейтральную или щелочную.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Любую соль можно представить, как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
Соли подвергаются гидролизу, если:
- Образована слабой кислотой и сильным основанием — гидролиз по аниону
- Образована сильной кислотой и слабым основанием — гидролиз по катиону
- Образована слабой кислотой и слабым основанием — гидролиз по катиону и аниону
- Совместный гидролиз — две соли, одна образована сильной кислотой и слабым основанием, другая слабой кислотой и сильным основанием.
Примеры гидролиза солей
Образована слабой кислотой и сильным основанием — гидролиз по аниону
$1. quad CO_3^ + H_2O = HCO_3^ +$ $OH^$ $ Rightarrow text >7 $
ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятно
$ 2.quad HCO_3^ + H_2O = H_2CO_3 +$ $OH^$
Образована сильной кислотой и слабым основанием — гидролиз по катиону
Образована слабой кислотой и слабым основанием — гидролиз по катиону и аниону
$1. quad NH_4^+ + HOH = NH_4OH +$ $H^+$ $Rightarrow H_2O, pH = 7, text$
$quad ;; CO_3^ + HOH = HCO_3^- +$ $OH^-$

Совместный гидролиз — две соли, одна образована сильной кислотой и слабым основанием, другая слабой кислотой и сильным основанием.
Факторы, влияющие на скорость гидролиза:
Усиливающие:
- Низкая концентрация вещества — гидролиз идет сильнее в разбавленных растворах
- Нагревание
- Связывание образующих ионово H + и OH —
Ослабевающие:
- Повышение концентрации вещества
- Низкая температура
- Добавление в раствор ионов H + или OH — для сдвига равновесия влево
Специфический гидролиз некоторых веществ
Гидролиз — это реакция обменного разложения веществ водой.
Источник: reshutest.ru
Чем отличаются гидролиз и гидратация? Подробное руководство с примерами
В ЕГЭ по химии в тестовой части часто бывают вопросы на гидролиз и гидратацию. Некоторые путают эти два химических термина, принимая одно за другое. Так происходит потому, что оба эти процесса включают взаимодействие с водой. На самом деле в этой теме легко разобраться. Ниже мы дадим определение этим понятиям и приведем примеры из школьного курса.
1. Гидролиз.
Давайте дадим, может быть, не самое академическое, но тем не менее довольно точное определение понятию «гидролиз»:
Гидролиз – это разложение «составных» химических соединений водой.
Это определение не самое академическое в том плане, что строгого понятия «составное соединение» в химии нет. Поэтому следует пояснить, что здесь имеется в виду. Под «составным соединением» следует понимать соединение, которое как бы состоит из нескольких частей либо было получено соединением нескольких частей.
Гидролиз солей. 9 класс.
В качестве первого примера можно привести соли. Абсолютно любая соль состоит из двух «частей» — катиона и аниона. Катион, как правило, представлен металлом, либо катионом аммония или его органическим производным (есть и другие, но в школе они не изучаются). Анион – это всегда кислотный остаток. Соединив катион и анион в соль, мы и получим «составное» соединение.
Тогда, если вернуться к нашему определению, гидролизом будет такое взаимодействие с водой, которое приведет к разложению соли. Именно это и происходит в действительности. Рассмотрим гидролиз соли на примере сульфида алюминия Al2S3.
Как мы хорошо знаем, гидролиз солей мы проводим отдельно по катиону и аниону. В случае Al2S3 гидролиз протекает и по катиону, и по аниону, потому что катиону Al 3+ соответствует слабое основание Al(OH)3, а аниону S 2- соответствует слабая кислота H2S. Тогда мы можем записать эти процессы и потом объединить их в суммарную реакцию:
Гидролиз по аниону:
S 2- + 2H2O = H2S↑ + 2OH —
Складываем эти два процесса, учитывая, что H + + OH — = H2O:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Итак, «составное» вещество разложилось под действием воды, следовательно, мы имеем дело с гидролизом.
Второй важный пример – это гидролиз сложных эфиров. На картинке ниже представлено уравнение этой реакции для метилацетата.
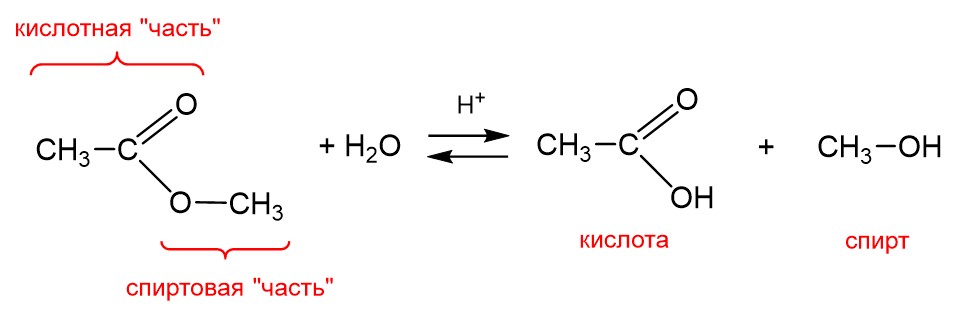
Здесь гидролизу снова подвергается «составное» вещество. Сложные эфиры получают по реакции карбоновых кислот со спиртами, поэтому в формуле сложного эфира можно выделить «кислотную часть» и «спиртовую часть», как показано на рисунке. Действием воды можно «разложить» сложный эфир на те компоненты, из которых он был получен, а именно на кислоту и спирт.
Поэтому мы снова имеем дело с «разложением составного вещества водой», то есть гидролизом. Правда, нужно иметь в виду, что гидролиз сложного эфира – это обратимый процесс. Чтобы сместить равновесие в сторону продуктов и сделать процесс необратимым, можно добавить щелочь. Но тогда это будет уже так называемый щелочной гидролиз.
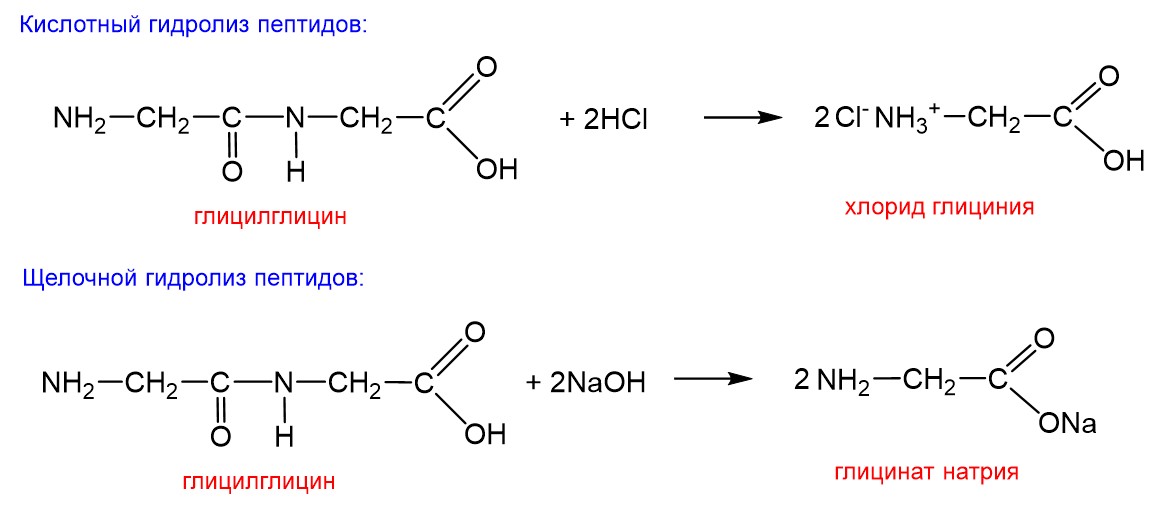
Третий пример – это гидролиз полипептидов. Полипептиды тоже представляют собой «составные» вещества в нашем понимании, поскольку получаются взаимодействием нескольких «исходных частей», то есть аминокислот. Гидролиз полипептидов именно в чистой воде не протекает, для этого требуются биологические катализаторы, называемые ферментами. Но возможен гидролиз полипептидов в кислой и щелочной среде. Ниже это показано на примере дипептида глицилглицина, то есть полученного соединением двух молекул глицина через пептидную связь:
В обоих случаях происходит гидролиз пептидной связи –CO–NH–. Несмотря на то что здесь требуется либо кислота, либо щелочь, этот процесс правомерно называть гидролизом. В формальном смысле в обоих случаях происходит разложение глицилглицина водой на две молекулы глицина. А далее в присутствии кислоты протонируется аминогруппа глицина с образованием хлорида глициния, а в присутствии щелочи образуется натриевая соль глицина – глицинат натрия.

Наконец четвертый пример гидролиза, который может встретиться на экзамене, — это гидролиз полисахаридов. Здесь удобно рассмотреть самый распространенный полисахарид крахмал, который получается поликонденсацией молекул α-глюкозы. То есть речь снова идет о «составном» веществе. На картинке ниже показана схема гидролиза крахмала:
Просто в воде процесс не идет, требуется присутствие либо кислоты, либо катализатора-фермента. Но в реакцию непосредственно вступает именно вода, поэтому мы имеем дело с гидролизом. В результате полимерная молекула крахмала распадается под действием воды на «исходные» части, то есть молекулы α-глюкозы.
Вряд ли на экзамене встретятся какие-либо иные случаи гидролиза помимо указанных выше четырех примеров.
2. Гидратация.
Гидратация тоже подразумевает взаимодействие с водой, тем не менее это совсем не то же самое, что гидролиз. Дадим определение гидратации:
Гидратация – это процесс присоединения молекулы воды к кратной связи.
Из этого следует, что вещество, подвергающееся гидратации, не обязательно должно быть составным. Во-вторых, при гидратации не происходит разложения вещества, потому что гидратация – это реакция присоединения.
В школьном курсе мы изучаем два примера реакции гидратации. Речь идет о гидратации алкенов и алкинов. Оба этих класса органических веществ как раз содержат кратные связи.

Ниже на рисунке приведена схема гидратации пропена, то есть алкена.
Молекулу воды можно схематически представить как H–OH. Теперь можно обсуждать присоединение воды к кратной связи как если бы у нас был галогеноводород. В строгом соответствии с правилом Марковникова фрагмент H из молекулы воды идет к углероду, связанному с наибольшим числом атомов водорода, то есть к =CH2.
А фрагмент OH идет к углероду, связанному с меньшим числом атомов Н, то к –CH=. В результате получаем пропанол-2. Произошло присоединение молекулы воды к двойной связи, следовательно, мы имели дело с гидратацией.

В качества примера гидратации алкина можно взять пропин:
Здесь применимы те же рассуждения. По правилу Марковникова фрагмент Н из молекулы воды идет к ≡СН, а фрагмент ОН идет к –С≡. В результате присоединения одной молекулы воды к тройной связи образуется промежуточное неустойчивое соединения класса енолов, которые имеют одновременно двойную связь (это «ен» из алкена) и спиртовую группу –ОН (это «ол» из спиртов). Такие енолы претерпевают перегруппировку и превращаются в нашем случае в кетон ацетон. Альдегид по такой реакции можно получить только гидратацией ацетилена.
Вот, собственно, эти два примера с алкенами и алкинами и нужно знать, если говорить о гидратации. Понятно, в алкенах и алкинах может быть разное число атомов углерода и не обязательно 3.
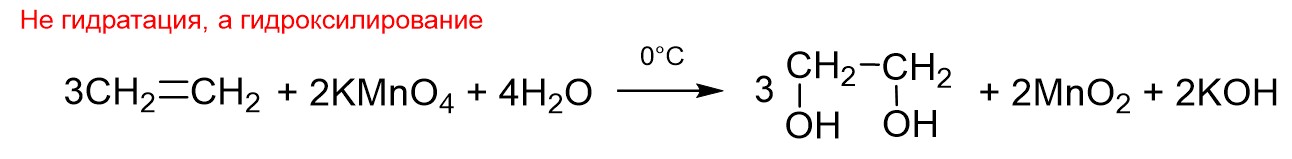
Еще гидратацией иногда называют реакцию Вагнера, но это ошибка. Реакция Вагнера — это взаимодействие алкенов с водным раствором перманганата калия при пониженной температуре. Ниже эта реакция показана на примере этилена.
Здесь гидратации, то есть присоединения молекулы воды, не происходит. Вместо воды к двойной связи присоединяются две ОН-группы. Процесс присоединения ОН-групп имеет свое отдельное химическое название – «гидроксилирование». Поэтому реакция Вагнера – это гидроксилирование, а не гидратация.
В заключении повторим, что различить гидролиз и гидратацию не так уж и сложно. Напомним, что гидролиз – это разложение «составного» вещества водой, а гидратация – это присоединение воды к кратной связи.
Хотите хорошо подготовиться к ЕГЭ по английскому или химии или изучать английский для себя? Запишитесь на занятия к автору сайта.
Занятия проходят онлайн, в удобном формате, в подходящее для вас время.
Источник: eng-chem.ru
Как ослабить или усилить гидролиз
Гидролиз соли – это ее взаимодействие с водой, в результате чего образуется слабый электролит. Само название процесса гидролиза, в переводе с греческого языка, означает «разложение водой». Гидролиз можно как усилить, так и ослабить, путем внешнего воздействия. Каким образом этого можно достичь?

Статьи по теме:
- Как ослабить или усилить гидролиз
- Как усилить гидролиз
- Как происходит взаимодействие кислот с солями
Инструкция
Одно из фундаментальных правил, касающихся протекания химических реакций, «принцип Ле Шателье», гласит, что при экзотермической реакции (идущей с выделением тепла), повышение температуры препятствует ее ходу, а при эндотермической (идущей с поглощением тепла) – напротив, способствует. Гидролиз – эндотермическая реакция. Следовательно, если вы повысите температуру раствора, он будет протекать легче и полнее. Напротив, если вы понизите температуру раствора, он будет ослаблен.
Чем выше концентрация соли, подвергающейся гидролизу, тем медленнее и труднее он идет. То есть, если вы хотите ослабить гидролиз, добавьте в раствор новую порцию соли. Соответственно, если вы хотим усилить гидролиз, уменьшите ее концентрацию.
Если в результате гидролиза один из его продуктов выпадает в осадок (то есть образуется малорастворимое соединение), или превращается в газ, гидролиз протекает до конца. Иными словами, сильному гидролизу соответствует удаление хотя бы одного продукта из реакционной зоны. Поскольку гидролиз – одна из разновидностей химических реакций, а это правило относится ко всем реакциям без исключения.
Эффективный метод усиления гидролиза – способ «взаимного усиления». Его суть заключается в том, что при смешивании растворов двух незначительно гидролизованных солей, одна из которых образована слабой кислотой и сильным основанием, а другая – сильной кислотой и слабым основанием, происходит связывание оказавшихся в одном растворе водород-ионов и гидроксил-ионов. В результате, согласно вышеупомянутому принципу Ле Шателье, «совместный» гидролиз протекает практически полностью.
Полезный совет
Любая соль состоит из аниона и катиона. Поэтому гидролиз может идти по одному из трех возможных вариантов. Если протекает гидролиз по аниону, то с водой взаимодействует только анион (в результате раствор будет щелочным), если по катиону, то, соответственно, только катион (в результате раствор будет кислым). Есть еще «совместный гидролиз», когда с водой взаимодействуют как анион, так и катион. А каков будет раствор в этом случае, зависит от силы кислоты и основания, образовавших соль.
Совет полезен?
Статьи по теме:
- Как поменять жидкость ГУР
- Что такое американская химия
- Три способа получения цинка из сульфида
Добавить комментарий к статье
Похожие советы
- Как уменьшить мочевую кислоту
- Как можно влиять на скорость протекания химической реакции
- Как промывать катетер
- Как поменять жидкость гидроусилителя руля
- Как определить температуру реакции
- Как изменить структуру воды
- Как перевести средние соли в кислые
- Работа закона “не притяжения”
- Как определить сильные и слабые электролиты
- Как соединить метапол
- Как увеличить колесную колею
- Куда уходит тормозная жидкость
- Как смещается равновесие экзотермической реакции
- Как промыть дроссельный узел
- Как повысить температуру двигателя
- Почему картридж течет
- Как найти константу равновесия
- Как определить силу кислоты
- От чего зависят кислотно-основные свойства
- Что нужно знать о гиалуроновой кислоте?
Источник: www.kakprosto.ru