Катализаторы применяют в разных областях: от очистки автомобильных выхлопов до производства азотной кислоты. Одним из самых эффективных и дорогих катализаторов является платина — благородный металл, который обладает уникальной способностью взаимодействовать с разными веществами.
Но как получить платиновый катализатор? Для этого нужно использовать специальное соединение платины, которое называется прекурсором или предшественником катализатора. Из прекурсора платины можно получить мельчайшие частицы платины, которые распределяются на поверхности носителя — другого материала, который улучшает свойства катализатора. Такая форма позволяет увеличить активную поверхность платины и сократить ее расход.
Большинство существующих прекурсоров платины — растворы сильных кислот, которые имеют ряд недостатков: они коррозийны, токсичны, разрушают носитель и требуют сложной очистки от примесей. Поэтому химикам нужны более безопасные и удобные прекурсоры платины, которые бы обеспечивали высокую активность и стабильность катализаторов.
Такие прекурсоры нашли сибирские ученые из Института неорганической химии имени А. В. Николаева (Новосибирск) в сотрудничестве с коллегами из Института катализа имени Г. К. Борескова. Они обнаружили, что в растворах гидроксида платины, которые долго стояли на воздухе, образуются карбонатные комплексы платины. Это соединения, в которых атомы платины связаны с атомами углерода и кислорода из углекислого газа, который проникает в раствор из атмосферы.
Карбонатные комплексы платины — новый класс соединений, которые ранее не были изучены. Они оказались достаточно устойчивыми, чтобы храниться в растворе, но при нагревании или длительном хранении они превращаются в наночастицы оксида платины. Эти наночастицы можно использовать для получения катализаторов, если добавить в раствор с карбонатными комплексами платины какой-либо твердый носитель, например оксид церия или графитоподобный нитрид углерода. Наночастицы оксида платины оседают на поверхности носителя и образуют катализатор.
Исследователи проверили активность полученных катализаторов в реакции разложения гидразина на водород и азот. Гидразин — вещество, которое используется как ракетное топливо, но также может служить источником и хранилищем водорода — экологически чистого топлива. В присутствии катализаторов на основе платины гидразин легко распадается на газы, которые можно использовать для различных целей.
Все испытанные катализаторы показали высокую эффективность и избирательность в этой реакции, то есть почти весь гидразин превращался в водород и азот, а не в другие продукты. Особенно выделился катализатор, в котором платина была сплавлена с никелем. Он позволял получать в 23 раза больше водорода из гидразина по сравнению с аналогичными катализаторами без никеля. Кроме того, этот катализатор был стабилен и сохранял свою активность после нескольких циклов реакции.
Таким образом, ученые показали, что карбонатные комплексы платины — перспективные прекурсоры для получения катализаторов на основе платины. Они имеют ряд преимуществ перед традиционными прекурсорами: они безопасны, доступны, легко контролируются и не требуют дополнительной очистки. Кроме того, они позволяют получать катализаторы с различными свойствами, добавляя разные носители или металлические сплавы. Такие катализаторы могут быть полезны для различных химических процессов, связанных с использованием водорода или других газов.
Это исследование стало частью более широкого проекта по изучению химии и физики платиновых соединений, который проводится в Институте неорганической химии имени А. В. Николаева под руководством доктора химических наук Павла Поповецкого. Целью проекта является создание новых материалов на основе платины для различных приложений, в том числе для энергетики, медицины и наноэлектроники.
Источник: vsluh.net
Как определить тип оксида?

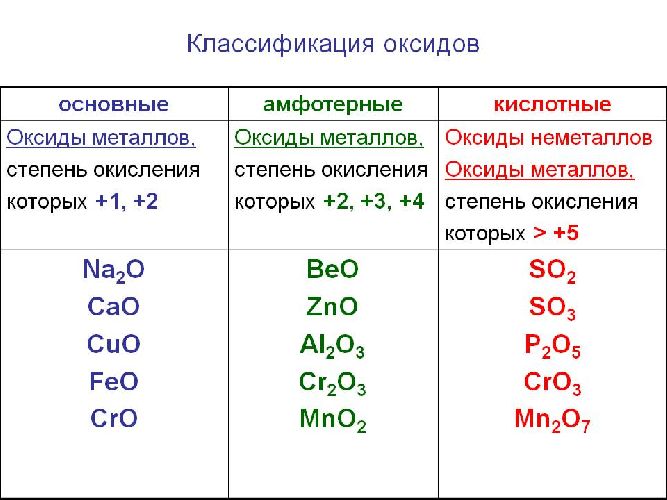
В заданиях ЕГЭ есть такие вопросы, где требуется определить тип оксида. Прежде всего, следует запомнить четыре типа оксидов:
Основные, кислотные и амфотерные оксиды часто также объединяют в группу солеобразующих оксидов.
Не вдаваясь в теоретические подробности, изложу пошаговый алгоритм определения типа оксида.
Первое — определите: оксид металла перед вами или оксид неметалла.
Второе — установив, какой оксид металла или неметалла перед вами, определите степень окисления элемента в нем и воспользуйтесь таблицей ниже. Естественно, правила отнесения оксидов в этой таблице нужно выучить. Поначалу можно решать задания, подглядывая в нее, но ваша цель ее запомнить, так как на экзамене никаких источников информации, кроме таблицы Д.И. Менделеева, таблицы растворимости и ряда активности металлов, у вас не будет.
1) Степень окисления неметалла +1 или +2
Вывод: оксид несолеобразующий
Исключение: Cl2O не относится к несолеобразующим оксидам
1) Степень окисления металла равна +1, +2
Вывод: оксид металла основный
Исключение: BeO, ZnO, SnO и PbO не относятся к основным оксидам!!
2) Степень окисления больше либо равна +3
Вывод: оксид кислотный
Исключение: Cl2O относится к кислотным оксидам, несмотря на степень окисления хлора +1
2) Степень окисления металла +3, +4,
Вывод: оксид амфотерный.
Исключение: BeO, ZnO, SnO и PbO амфотерны, несмотря на степень окисления +2 у металлов
3) Степень окисления металла +5,+6,+7
Вывод: оксид кислотный.
Примеры:
Задание: определите тип оксида MgO.
Решение: MgO является оксидом металла, при этом степень окисления металла в нем +2. Все оксиды металлов в степени окисления +1 и +2 основны, кроме оксида бериллия или цинка.
Ответ: MgO – основный оксид.
Задание: определите тип оксида Mn2O7
Решение: Mn2O7 – оксид металла, и степень окисления металла в этом оксиде равна +7. Оксиды металлов в высоких степенях окисления (+5,+6,+7) относятся к кислотным.
Ответ: Mn2O7 – кислотный оксид
Задание: определите тип оксида Cr2O3.
Решение: Cr2O3 – оксид металла, и степень окисления металла в этом оксиде равна +3. Оксиды металлов в степенях окисления +3 и +4 относятся к амфотерным.
Ответ: Cr2O3 – амфотерный оксид.
Задание: определите тип оксида N2O.
Решение: N2O – оксид неметалла, и степень окисления неметалла в этом оксиде равна +1. Оксиды неметаллов в степенях окисления +1 и +2 относятся к несолеобразующим.
Ответ: N2O – несолеобразующий оксид.
Задание: определите тип оксида BeO.
Решение: оксид бериллия, а также оксид цинка являются исключениями. Несмотря на степень окисления металлов в них, равную +2, они амфотерны.
Ответ: BeO – амфотерный оксид.
С химическими свойствами оксидов можно ознакомиться здесь
Источник: scienceforyou.ru
Основные оксиды

Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород. Оксиды могут быть солеобразующими и несолеобразующими: одним из видов солеобразующих оксидов являются основные оксиды. Чем они отличаются от других видов, и каковы их химические свойства?
Классификация оксидов
Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные оксиды. Если основным оксидам соответствуют основания, то кислотным – кислоты, а амфотерным оксидам соответствуют амфотерные образования. Амфотерными оксидами называют такие соединения, которые в зависимости от условий могут проявлять либо основные, либо кислотные свойства.
Физические свойства оксидов очень разнообразны. Они могут быть как газами (CO2), так и твердыми (Fe2O3) или жидкими веществами (H2O).
При этом большинство основных оксидов является твердыми веществами различных цветов.
оксиды, в которых элементы проявляют свою высшую активность называются высшими оксидами. Порядок возрастания кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
Химические свойства основных оксидов
Основными оксидами называются оксиды, которым соответствуют основания. Например, основным оксидам K2O, СaO соответствуют основания KOH, Ca(OH)2 .

Основные оксиды образуются типичными металлами, а также металлами переменной валентности в низшей степени окисления (например, CaO, FeO), реагируют с кислотами и кислотными оксидами, образуя при этом соли:
CaO (основной оксид)+CO2 (кислотный оксид)=СaCO3 (соль)
FeO (основной оксид)+H2 SO4 (кислота)=FeSO4 (соль)+2H2O (вода)
Основные оксиды также взаимодействуют с амфотерными оксидами, в результате чего происходит образование соли, например:
CaO+ZnO=CaZnO2
С водой реагируют только оксиды щелочных и щелочно-земельных металлов:
BaO (основной оксид)+H2O (вода)=Ba(OH)2 (основание щелочнозем. металла)
Многие основные оксиды имеют характер восстанавливаться до веществ, состоящих из атомов одного химического элемента:
3CuO+2NH3 =3Cu+3H2 O+N2
При нагревании разлагаются только оксиды ртути и благородных металлов:
2AU2O=4Au+O2

Список основных оксидов:
| Название оксида | Химическая формула | Свойства |
| Оксид кальция | CaO | негашенная известь, белое кристаллическое вещество |
| Оксид магния | MgO | белое вещество, малорастворимое в воде |
| Оксид бария | BaO | бесцветные кристаллы с кубической решеткой |
| Оксид меди II | CuO | вещество черного цвета практически нерастворимое в воде |
| Оксид ртути II | HgO | твердое вещество красного или желто-оранжевого цвета |
| Оксид калия | K2O | бесцветное или бледно-желтое вещество |
| Оксид натрия | Na2O | вещество, состоящее из бесцветных кристаллов |
| Оксид лития | Li2 O | вещество, состоящее из бесцветных кристаллов, которые имеют строение кубической решетки |
В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов
Что мы узнали?
При образовании основных оксидов одним из обязательных элементов является кислород.Основные оксиды обладают рядом физических и химических свойств, таких как взаимодействие с водой, кислотами и другими оксидами.
Источник: obrazovaka.ru