Первый октябрьский тренировочный (пробный) вариант по химии №3 от группы “ЕГЭ на 100 баллов”. Вариант полностью соответствует реальному КИМу по информатике для сдачи государственного экзамена в 11 классе. Вариант содержит ответы на первую часть и критерии для проверки второй части. Решение тренировочных вариантов позволит вам лучше подготовиться к сдаче экзамена.
Дата составления варианта 01 октября 2018. Тренировочный вариант доступен для просмотра или скачивания. Свои предложения, вопросы и пожелания вы можете оставить внизу в комментариях. Буду благодарен если вы поделитесь этой записью в соцсетях.
Похожие записи — ЕГЭ 2019. Пробный вариант по химии №1
Удачи в сдаче экзамена!
Источник: pro-gia.ru
Задания 32 из реального ЕГЭ по химии
Задания 32 из реального ЕГЭ по химии-2021, все задачи на неорганическую химию (мысленный эксперимент) из реального экзамена ЕГЭ по химии, задания 32 из реального ЕГЭ 2021 (основная волна и резервные дни — 30 мая 2021 года) с текстовыми решениями и ответами.
Все задания №32 из сборника ЕГЭ 2023 (часть 1) | Химия ЕГЭ для 10 класса | Умскул
1. Фосфид алюминия растворили в бромоводородной кислоте. К полученному при этом раствору добавили избыток раствора гидроксида натрия. Через получившийся раствор пропустили газ с резким запахом, образовавшийся в результате полного растворения сульфида железа(II) в концентрированной серной кислоте. Напишите уравнения четырех описанных реакций.
AlBr3 + 4NaOH = Na[Al(OH)4] + 3NaBr (допустимо образование Na3[Al(OH)6])
2. Кристаллический иодид аммония нагрели с твёрдым гидроксидом натрия. Получившуюся соль растворили в воде и поместили в раствор нитрата меди(II). Выпавшую в осадок соль отделили и поместили в концентрированный раствор серной кислоты, при этом происходило выделение газа с резким запахом и образование окрашенного простого вещества.
Полученное простое вещество отделили и поместили в горячий раствор гидроксида натрия. Напишите уравнения четырех описанных реакций.
3. Оксид кремния при нагревании прореагировал с избытком магния. Одно из получившихся при этом соединений магния поместили в воду. Выделившийся при этом газ полностью поглотили раствором, содержащим перманганат калия и гидроксид калия. Из полученного раствора зелёного цвета выделили соединение кремния и поместили его в раствор бромоводородной кислоты.
Напишите уравнения четырех описанных реакций.
4. Сульфид алюминия растворили в избытке раствора гидроксида калия. Полученное в результате соединение серы выделили и поместили в раствор сульфата хрома(III). Образовавшийся осадок отделили и нагрели с перхлоратом калия и гидроксидом калия. Полученную соль хрома отделили, растворили в воде и поместили в раствор нитрата серебра.
Напишите уравнения четырех описанных реакций.
5. Нитрат железа(II) прокалили. Полученный твёрдый остаток растворили в растворе иодоводородной кислоты. Образовавшуюся соль железа поместили в раствор азотной кислоты и наблюдали образование окрашенного простого вещества и выделение бурого газа. Простое вещество отделили, а к оставшемуся раствору соли прилили раствор карбоната калия.
Реальный ЕГЭ по химии | Задание 32. 1
Напишите уравнения четырех описанных реакций.
6. Фосфид алюминия растворили в соляной кислоте. К полученному при этом раствору добавили избыток раствора гидроксида калия. Через получившийся раствор пропустили газ с резким запахом, образовавшийся в результате полного растворения сульфида меди(I) в концентрированной серной кислоте. Напишите уравнения четырех описанных реакций.
AlCl3 + 4KOH = K[Al(OH)4] + 3KCl (допустимо образование K3[Al(OH)6])
7. Хлорид кремния(IV) поместили в воду. Выделившийся при этом осадок отделили, а в оставшийся раствор внесли фосфид цинка. Образовавшийся при этом газ пропустили через раствор, содержащий дихромат натрия и серную кислоту. Полученную при этом соль хрома выделили, растворили в воде и к полученному раствору добавили раствор карбоната калия.
Напишите уравнения четырех описанных реакций.
8. Кристаллический иодид аммония нагрели с твёрдым гидроксидом калия. Получившуюся соль растворили в воде и поместили в раствор сульфата меди(II). Выпавшую в осадок соль отделили и поместили в концентрированный раствор азотной кислоты, при этом наблюдали выделение бурого газа и образование окрашенного простого вещества.
Полученное простое вещество отделили и поместили в горячий раствор гидроксида калия. Напишите уравнения четырех описанных реакций.
9. Нитрат железа(III) прокалили. Полученный твёрдый остаток растворили в растворе иодоводородной кислоты. Образовавшуюся соль железа поместили в концентрированный раствор серной кислоты и наблюдали образование окрашенного простого вещества и выделение газа с резким запахом. Простое вещество отделили, а к оставшемуся раствору соли прилили раствор карбоната натрия.
Напишите уравнения четырех описанных реакций.
10. Сульфид алюминия растворили в избытке раствора гидроксида натрия. Полученное в результате соединение серы выделили и поместили в раствор нитрата хрома(III). Образовавшийся осадок отделили и нагрели с перхлоратом натрия и гидроксидом натрия. Полученную соль хрома отделили, растворили в воде и поместили в раствор ацетата серебра.
Напишите уравнения четырех описанных реакций.
11. Железную окалину растворили в разбавленной серной кислоте. Полученный раствор обработали иодидом калия. Образовавшуюся соль бескислородной кислоты поместили в раствор азотной кислоты и наблюдали образование окрашенного простого вещества и выделение бурого газа. Простое вещество отделили, а к оставшемуся раствору соли прилили раствор карбоната калия.
Напишите уравнения четырех описанных реакций.
12. Фосфор смешали с магнием и нагрели. Полученное при этом вещество поместили в воду. Выделившийся газ пропустили через раствор, содержащий перманганат калия и гидроксид калия, в результате раствор приобрёл зелёную окраску. Через полученный раствор пропустили хлор, при этом наблюдали изменение цвета раствора.
Напишите уравнения четырех описанных реакций.
13. Иодид калия прореагировал с нитритом калия в присутствии серной кислоты. Образовавшийся при этом газ собрали в колбу и наблюдали, как при стоянии на воздухе газ в колбе постепенно окрасился в бурый цвет. Полученный бурый газ смешали с кислородом и пропустили через воду, при этом образовалась кислота.
В полученный концентрированный раствор кислоты внесли пирит, при этом наблюдали его полное растворение и выделение бурого газа. Напишите уравнения четырех описанных реакций.
14. Сульфид натрия прореагировал с нитритом натрия в присутствии серной кислоты. Образовавшийся при этом газ собрали в колбу и наблюдали, как при стоянии на воздухе газ в колбе постепенно окрасился в бурый цвет. Полученный бурый газ смешали с кислородом и пропустили через воду, при этом образовалась кислота.
В полученный концентрированный раствор кислоты внесли сульфид меди(I), при этом наблюдали его полное растворение и выделение бурого газа. Напишите уравнения четырех описанных реакций.
15. Фосфид цинка растворили в соляной кислоте. Полученный газ разделили на две части, одну часть поглотили раствором, содержащим перманганат калия и гидроксид калия, в результате раствор приобрёл зелёную окраску. Другую часть газа поглотили раствором дихромата калия, подкисленным серной кислотой.
Полученную при этом соль хрома выделили, растворили в воде и к полученному раствору добавили раствор карбоната натрия. Напишите уравнения четырех описанных реакций.
Источник: chemege.ru
Задание 32. Органическая цепочка. ЕГЭ 2023 по химии

За это задание ты можешь получить 5 баллов. На решение дается около 15 минут. Уровень сложности: высокий.
Средний процент выполнения: 44.9%
Ответом к заданию 32 по химии может быть развернутый ответ (полная запись решения с обоснованием выполненных действий).
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $3CH_2=CH_2 + 2KMnO_4 + 4H_2O → 3CH_2(OH)–CH_2OH + 2MnO_2 + 2KOH$
2) $CH_2(OH)–CH_2OH + 2HCl → CH_2Cl–CH_2Cl + 2H_2O$
3) $CH_2Cl–CH_2Cl + 2KOH_ → CH≡CH + 2KCl + 2H_2O$

4) $CH≡CH + H_2O →↖>$
5) $CH_3CHO$ + $2[Ag(NH_3)_2]OH$ → 2Ag + $3NH_3$ + $H_2O$ + $CH_3COONH_4$
Ответ:
Показать решение
Задача 2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $C_6H_O_6 →↖ 2C_2H_5OH + 2CO_2$
2) $C_2H_5OH →↖ 140 °C> CH_2=CH_2 + H_2O$
3) $CH_2=CH_2 +$ 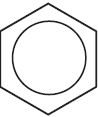 $→↖$
$→↖$ 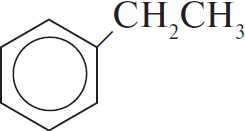
4) $Cl_2 +$  $→↖ HCl +$
$→↖ HCl +$ 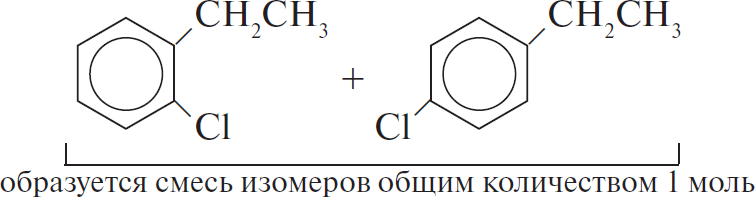
5) $12KMnO_4 + 18H_2SO_4 +$ 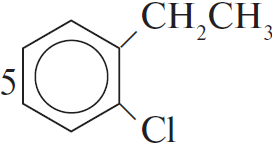 $→ 12MnSO_4 + 6K_2SO_4 + 28H_2O + 5CO_2 +$
$→ 12MnSO_4 + 6K_2SO_4 + 28H_2O + 5CO_2 +$ 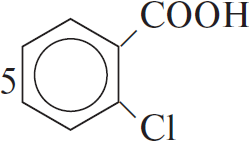
$12KMnO_4 + 18H_2SO_4 +$ 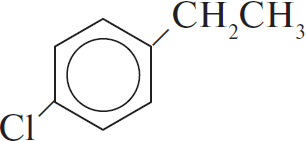 $→ 12MnSO_4 + 6K_2SO_4 + 28H_2O + 5CO_2 +$
$→ 12MnSO_4 + 6K_2SO_4 + 28H_2O + 5CO_2 +$ 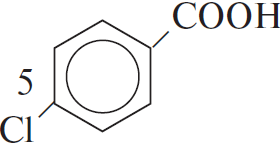
Ответ:
Показать решение
Задача 3
Напишите уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
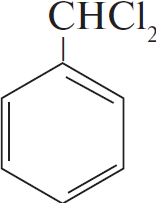
$н-гептан →↖ Х_1 →↖$ $→↖, t°> X_2 →↖ X_3 →↖, t°> X_4$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
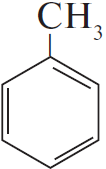
1) $CH_3CH_2CH_2CH_2CH_2CH_2CH_3 →↖ 4H_2 +$
2)  $+ 2Cl_2 →↖ 2HCl +$
$+ 2Cl_2 →↖ 2HCl +$ 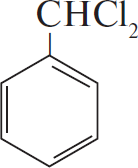
3)  $+2КOH → 2КCl + H_2O +$
$+2КOH → 2КCl + H_2O +$ 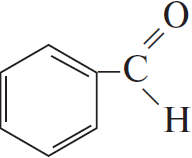

4) 5 $+ 2KMnO_4 + 3H_2SO_4 →5$ C6H5COOH$+ 2MnSO_4 + K_2SO_4 + 3H_2O$
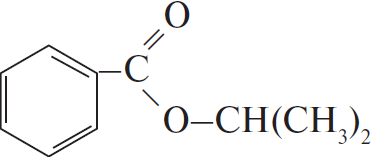
5) С6H5COOH $+ CH_3–CH(OH)–CH_3 → H_2O +$
Ответ:
Показать решение
Задача 4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
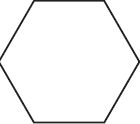
$ацетилен →↖, t°> Х_1 →↖ Х_2 →↖$ $–Cl →↖, t°> X_3 →↖ X_4$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение

1) $3CH≡CH →↖, t°>$
2)  $+ 3H_2 →↖$
$+ 3H_2 →↖$ 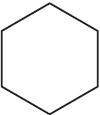
3)  $+ Cl_2 →↖ HCl +$
$+ Cl_2 →↖ HCl +$ 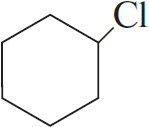
4)  $+ KOH_ <(спирт. р-р)>→↖ KCl + H_2O +$
$+ KOH_ <(спирт. р-р)>→↖ KCl + H_2O +$ 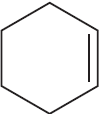
5) 3  $+ 2KMnO_4 + 4H_2O → 3$
$+ 2KMnO_4 + 4H_2O → 3$ 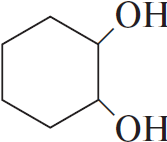 $+ 2MnO_2 + 2KOH$
$+ 2MnO_2 + 2KOH$
Ответ:
Показать решение
Задача 5
Приведите уравнения химических реакций, которые позволяют осуществить следующие превращения:
$C_2H_5OH → CH_2=CH_2 →↖ X_1 →$$→↖ X_2 →↖ X_3$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $C_2H_5OH →↖, t > 140 °C> CH_2=CH_2 + H_2O$
2) $CH_2=CH_2 + HCl → CH_3–CH_2Cl$
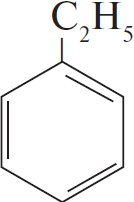
3) $CH_3–CH_2Cl +$ 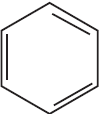 $→↖ HCl +$
$→↖ HCl +$ 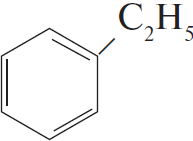
4) $5C_6H_5C_2H_5 + 12KMnO_4 + 18H_2SO_4 → 5C_6H_5COOH + 5CO_2 + 6K_2SO_4 + 12MnSO_4 + 28H_2O$
5) 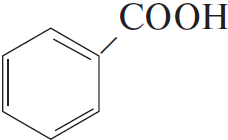 $+ HONO_ →↖, t°> H_2O +$
$+ HONO_ →↖, t°> H_2O +$ 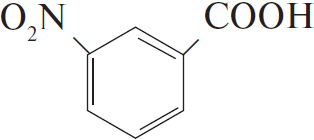
Ответ:
Показать решение
Задача 6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH≡CH + H_2O → CH_3–CHO$
2) $3CH_3CHO + K_2Cr_2O_7 + 4H_2SO_4 → 3CH_3COOH + K_2SO_4 + Cr_2(SO_4)_3 + 4H_2O$
3) $CH_3COOH + NaHCO_3 → CH_3COONa + H_2O + CO_2$
4) $CH_3COONa + CH_3I → CH_3COOCH_3 + NaI$
5) $CH_3COOCH_3 + H_2O ⇄ CH_3COOH + CH_3OH$
Ответ:
Показать решение
Задача 7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
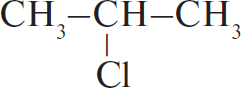
1) $CH_3–CH_2–CH_3 + Cl_2 →↖$ $+ HCl$
2) 2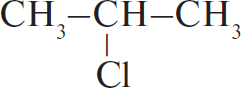 $+ 2Na →↖ 2NaCl +$
$+ 2Na →↖ 2NaCl +$ 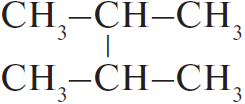
3) 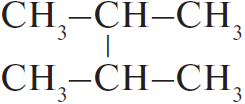 $+ Cl_2 →↖ HCl +$
$+ Cl_2 →↖ HCl +$ 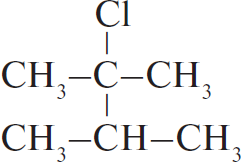
4) 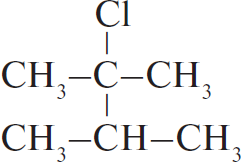 $+ NaOH_ →↖ NaCl + H_2O +$
$+ NaOH_ →↖ NaCl + H_2O +$ 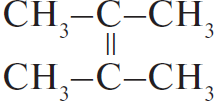
5) 3 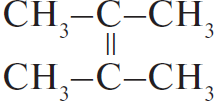 $+ 2KMnO_4 + 4H_2O →$
$+ 2KMnO_4 + 4H_2O →$ 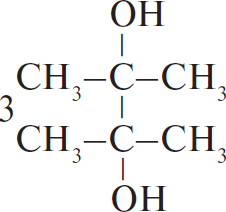 $+ 2MnO_2 + 2KOH$
$+ 2MnO_2 + 2KOH$
Ответ:
Показать решение
Задача 8
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) 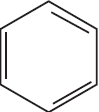 $+ 3H_2 →↖$
$+ 3H_2 →↖$ 
2)  $+ Cl_2 →↖ HCl +$
$+ Cl_2 →↖ HCl +$ 
3)  $+ NaOH_ <(водн. р-р)>→↖ NaCl +$
$+ NaOH_ <(водн. р-р)>→↖ NaCl +$ 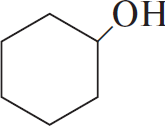
4)  $→↖, t > 140 °C> H_2O +$
$→↖, t > 140 °C> H_2O +$ 

5) $+ 8KMnO_4 + 12H_2SO_4 → 8MnSO_4 + 4K_2SO_4 + 12H_2O + 5HOOC–(CH_2)_4–COOH$
Ответ:
Показать решение
Задача 9
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH_3CH_2CH_2CH_2OH → CH_3CH_2–CH=CH_2 + H_2O$
2) $CH_3CH_2–CH=CH_2 + HBr → CH_3CH_2–CHBr–CH_3$
3) $CH_3CH_2–CHBr–CH_3 + KOH_ → CH_3CH_2–CH(OH)–CH_3 + KBr$
4) $CH_3CH_2–CH(OH)–CH_3 → CH_3–CH=CH–CH_3 + H_2O$
5) $5CH_3–CH=CH–CH_3 + 8KMnO_4 + 12H_2SO_4 → 10CH_3–COOH + 4K_2SO_4 + 8MnSO_4 + 12H_2O$
Ответ:
Показать решение
Задача 10
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
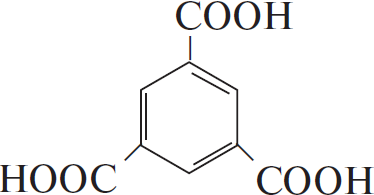
$пропан →↖ Х_1 → 1.2-дибромпропан →↖, t°> Х_2 →↖ Х_3 →↖$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH_3–CH_2–CH_3 → CH_3–CH=CH_2 + H_2$
2) $CH_3–CH=CH_2 + Br_2 → CH_3–CHBr–CH_2Br$
3) $CH_3–CHBr–CH_2Br + 2NaOH_ <(спирт. р-р)>→ CH_3–C≡CH + 2NaBr + 2H_2O$
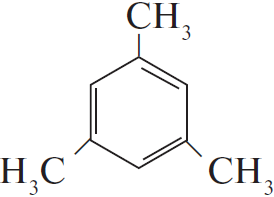
4) $3CH_3–C≡CH →↖, t°>$
5) $18KMnO_4 + 27H_2SO_4 + 5$  $→ 18MnSO_4 + 9K_2SO_4 + 42H_2O + 5$
$→ 18MnSO_4 + 9K_2SO_4 + 42H_2O + 5$ 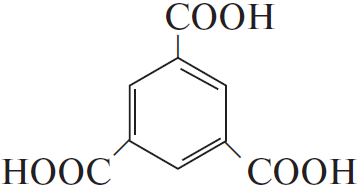
Ответ:
Показать решение
Задача 11
Напишите уравнения реакций, которые позволяют осуществить следующие превращения:
$Al_4C_3 → X_1 → нитрометан →↖ X_2 →↖ X_3 →↖ X_4$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $Al_4C_3 + 12H_2O → 4Al(OH)_3 + 3CH_4$
2) $CH_4 + HONO_2 → CH_3NO_2 + H_2O$
3) $CH_3NO_2 + 3H_2 → CH_3NH_2 + 2H_2O$
4) $CH_3NH_2 + HI → [CH_3NH_3]^I^$
5) $[CH_3NH_3]^I^ + NaOH → CH_3NH_2 + NaI + H_2O$
Ответ:
Показать решение
Задача 12
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
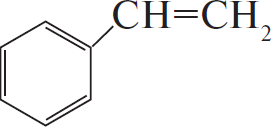
$C_6H_5COOK →↖ X_1 →↖ X_2 →↖ X_3 →$ $→↖ X_4$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) 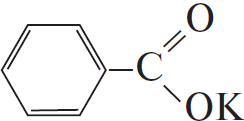 $+ KOH_ → K_2CO_3 +$
$+ KOH_ → K_2CO_3 +$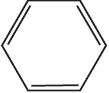
2) $+ CH_2=CH_2 →↖$ $–CH_2–CH_3$
3)  $–CH_2–CH_3 + Cl_2 →↖$
$–CH_2–CH_3 + Cl_2 →↖$ 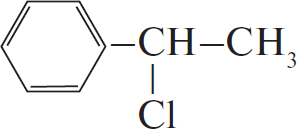 $+ HCl$
$+ HCl$
4) $C_6H_5–CH(Cl)–CH_3 + KOH_ → C_6H_5–CH=CH_2 + KCl + H_2O$
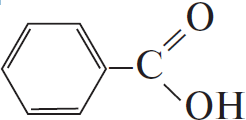
5) $C_6H_5–CH=CH_2 + 2KMnO_4 + 3H_2SO_4 → K_2SO_4 + 2MnSO_4 + 4H_2O + CO_2 +$
Источник: egeturbo.ru