что в критической точке поверхностное натяжение жидкости обращается в нуль. В настоящее время критические явления исследуются рядом отечественных и зарубежных ученых. В данной работе из трех критических параметров (T k ,P k ,V k ), характеризующих критическое состояние, определяется только критическая температура (P k и V k считаются известными).
Кроме того, визуально наблюдается процесс перехода жидкости (гексафторида серы SF 6 ) через критическое состояние и сопутствующие этому переходу явления. Метод определения критической температуры основан на появлении и исчезновении поверхности раздела фаз — мениска.
Исследуемая жидкость (SF 6 ) помещена в три стеклянные ампулы (в разных количествах), которые после удаления из них воздуха запаиваются. Для предотвращения возможных последствий разрыва стеклянных ампул они помещены в плексигласовый бокс. Бокс снабжен охладительной и нагревательной системами, представляющими собой вентилятор, нагнетающий в бокс горячий или холодный воздух.
Термодинамика | термодинамические параметры
Рядом с ампулами помещен термометр, с помощью которого измеряют температуру в боксе, она должна быть приблизительна равна температуре в ампулах. За перемещением мениска в ампулах наблюдают с помощью катетометра, поочередно настраивая его на ту или на другую ампулу.
Нагревание ампулы приводит к возрастанию температуры и давления паров SF 6 , к уменьшению сил поверхностного натяжения и исчезновению кривизны мениска. При определенной температуре мениск внезапно исчезает, и ампула представляется заполненной однородным веществом.
Исчезновение видимой границы раздела показывает, что плотности вещества по обе стороны от прежней границы стали одинаковыми. Следовательно, та температура, при которой исчезает мениск, и есть критическая температура.
Если теперь достаточно интенсивно охладить ампулу, нагретую до температуры выше критической, то в момент прохождения через критическую температуру возникает внезапное помутнение всего содержимого ампулы. После этого вновь появляется резкая граница раздела между жидкостью и паром. Это явление получило название критической опалесценсии, т.е. явления сильного рассеяния света.
Из-за чего оно возникло? На свойства вещества, находящегося в критическом состоянии, существенное влияние оказывают флуктуации плотности (местные разряжения и уплотнения, возникающие в результате теплового движения молекул).
В критической точке, где объемная упругость вещества обращается в нуль (исчезает поверхностное натяжение), изменение плотности практически не сопровождается изменением давления, вследствие чего величина флуктуаций чрезвычайно возрастает. Обусловленная такими большими флуктуациями оптическая неоднородность вещества приводит к рассеянию света на этих неоднородностях флуктуационной природы, и наблюдается явление критической опалесценсии (т.е. длина волны света становится соизмеримой с размером оптической неоднородности).
Вдали от критической точки флуктуации плотности незначительны и рассеяние света слабое. Критическая опалесценсия — это одно из наиболее ярких проявлений критического состояния вещества. Таким образом, критическую температуру жидкости легко определить, измерив температуру, при которой исчезает и появляется мениск в герметично закрытой ампуле с жидкостью.
Консультация по термодинамике. Часть 3. Билеты 18-22
Если ампула в описанном выше опыте содержит ровно столько жидкости, сколько нужно для того, чтобы ее пар, обладая критической плотностью, заполнил весь объем ампулы, то при нагревании мениск не будет перемещаться вдоль ампулы. В этом случае говорят о критическом заполнении ампулы. Если же в ампулу поместить большее количество жидкости, то при повышении температуры мениск будет перемещаться вверх. В этом случае говорят о сверхкритическом заполнении ампулы. Наконец, если в ампулу поместить количество жидкости, меньшее критического заполнения, то при повышении температуры мениск будет перемещаться вниз и заполнение будет докритическое .
Рис.2. Общий вид катетометра 1 — источник питания; 2 — уровень; 3 — колонка; 4 — микрометрический винт вертикального перемещения; 5 — осветитель; 6 — окуляр; 7 — винт; 8 — каретка; 9 — ролик; 10 — трос; 11 — маховичок; 12 — линза насадочная; 13 — труба визирная; 14 — уровень; 15 — винт микрометрического уровня; 16 — рукоятка; 17 — винт; 18 — основание; 19 — регулируемая опора; 20 — микрометрический винт горизонтального перемещения; 21 — винт В настоящей работе за перемещением мениска в ампулах следят с помощью катетометра, предназначенного для бесконтактного измерения расстояния между двумя точками, расположенными на одной вертикали в недоступных для непосредственного измерения объектах. Принцип действия катетометра основан на сравнении измеряемой длины (расстояние между двумя точками объекта) с миллиметровой шкалой прибора путем последовательного наведения в перекрестье шкалы прибора начала и конца измеряемого отрезка. Оптическую систему прибора составляет визирная труба, отсчётный микроскоп с подсветкой шкалы и система блока уровня (рис.2). В поле зрения окуляра видны одновременно изображения 5
измеряемого объекта, шкалы, масштабной сетки и концов пузырька уровня. Визирная труба, блок уровня и отсчетный микроскоп смонтированы на одной каретке. Визирование на выбранные точки измеряемого объекта осуществляется перемещением каретки по колонке вдоль миллиметровой шкалы, а также вращением колонки вокруг вертикальной оси.
Необходимо помнить, что изображение в визирной трубе катетометра перевернутое, т.е. если катетометр фиксирует опускание мениска, то на самом деле он поднимается, и наоборот. При наблюдении за перемещением мениска необходимо при фиксированной начальной температуре записать показания отсчетного микроскопа.
С этой целью необходимо навести с помощью микрометрического винта вертикального перемещения 4 при закрепленном винте 7 и микрометрического винта горизонтального перемещения 20 при закрепленном винте 21 и отпущенном винте 17 выпуклую часть мениска одной из ампул в перекрестье визирной трубы 13. Вращением маховичка 11 добиться резкости изображения.
Отсчеты снимаются по шкале и масштабной сетке, наблюдаемой в окуляр визирной трубы (при точной наводке следите за тем, чтобы концы пузырька уровня образовывали плавную дугу). Масштабная сетка разделена в вертикальном и горизонтальном направлении на 10 частей.
Отсчетный микроскоп установлен так, что 10 горизонтальных бисекторов сетки укладываются между двумя штрихами миллиметровой шкалы. Следовательно, в вертикальном направлении каждому биссектору соответствует 1/10 мм, в горизонтальном направлении десятая часть бисектора равна 1/100 мм.
То есть, на рис.2 отсчет равен 162 мм плюс отрезок от 162-го штриха до нулевого бисектора, в данном случае 2. Отсчет сотых долей миллиметра производится в горизонтальном направлении сетки там, где миллиметровый штрих шкалы расположен точно посредине бисектора. На рисунке миллиметровый штрих находится между четвертым и пятым делениями масштабной вертикальной сетки, что соответствует значению 0,04.
Окончательный отсчет равен 162,24. Аналогичным образом снимают показания перемещения мениска с повышением температуры. 3. Методика проведения эксперимента П о д г о т о в к а к о п ы т у Ознакомиться с описанием работы, инструкциями по ее проведению и лабораторной установкой. Внимание! Питание установки осуществляется напряжением 220 В, соблюдайте осторожность при работе!
Не забывайте, что давление в стеклянных ампулах превышает в несколько десятков раз атмосферное давление. Не рассматривайте ампулы с близкого расстояния! Категорически запрещается вынимать ампулы из бокса! З а д а н и е 1. Настроить катетометр с помощью прицельного устройства на одну из ампул, пользуясь при этом винтами 4 и 20. Вращением маховичка 11 добиться четкого изображения.
При этом выпуклая часть мениска (основание) должна находиться в перекрестье визирной трубы. 2. Зафиксировать по шкале положение мениска в исследуемой ампуле (предварительно включив осветитель шкалы). Записать показания термометра, расположенного рядом с ампулами. 3. Аналогичным образом зафиксировать положения мениска в двух других ампулах. 4. Полученные результаты поместить в таблицу.
| Экспериментальные данные | |||
| Положение мениска, мм | |||
| № | 1 ампула | 2 ампула | 3 ампула |
| п.п. | |||
| 1. | |||
| 2. | |||
| Значение | критической | температуры, ° С | |
5. Закрыть люк и отверстия бокса, включить вентилятор в сеть, а тумблер «охлаждениенагрев» поставить в положение «нагрев». Вентилятор должен при этом обязательно вращаться. 6. Приблизительно через каждые 5 0 С производить замер положения мениска во всех трех ампулах с занесением результатов замера в таблицу. Зафиксировать температуру полного исчезновения мениска в каждой ампуле.
7. Продолжать нагрев ампул до температуры, превышающей критическую на 3 — 5 0 С. 8. Затем быстро охладить ампулы. Для этого переключить тумблер «охлаждение-нагрев» в положение «охлаждение» и открыть люк и отверстия бокса. Наблюдать явление критической опалесценсии.
9. Снова зафиксировать момент появления мениска во всех трех ампулах при их охлаждении и записать соответствующую ему температуру. 10. Ампулу, в которой перемещения мениска при нагревании минимальны (эта ампула наиболее близка к критическому заполнению), нагреть и охладить не менее трех раз для более точного определения критической температуры. 11. Выключить все приборы из сети. 12.
Рассчитать среднее значение критической температуры и погрешность ее измерения. 13. Пользуясь измеренным значением критической температуры и известным мольным объемом, подсчитать критическое давление: a) из уравнения состояния идеальных газов; б) из уравнения состояния реальных газов, определив предварительно константы уравнения Ван-дер-Ваальса.
Сравнить расчетные значения P k с действительным. Сделать выводы о применимости соответствующих уравнений состояния для критической точки вещества. 14. Пользуясь уравнением Ван-дер-Ваальса, построить критическую изотерму графически. 4. Контрольные вопросы 1. Что такое критическое состояние вещества? 2. Каков физический смысл констант уравнения Ван-дер-Ваальса и их размерность?
Какова связь констант уравнения Ван-дер-Ваальса с критическими параметрами? 3. Что такое критический коэффициент? Каков он (по порядку величины) для реальных газов? 4. Почему при критическом заполнении ампулы мениск не перемещается с изменением температуры? 5. Почему в критической точке поверхностное натяжение обращается в нуль?
Что об этом свидетельствует в эксперименте? 6. Что такое явление критической опалесценсии? Список литературы 1. Сивухин Д.В . Общий курс физики: Термодинамика и молекулярная физика. М.:Наука, 1979. 2. Пригожин И.,Дефей Р . Химическая термодинамика. Новосибирск:Наука, 1966. 3. Семенченко В.К . Избранные главы теоретической физики. М.: Просвещение, 1966. 4. Матвеев А.Н. Молекулярная физика.
М.: Высш.шк., 1987. 7
Источник: studfile.net
Параметры критического состояния вещества
При высоких температурах последний член в (5) можно опустить, и тогда изотерма будет гиперболой, асимптотами которой являются изобара Р = 0 и изохора V = b.
Для исследования изотерм при любых значениях Т умножим уравнение (4) на V 2 . После раскрытия скобок уравнение изотермы примет вид
Это уравнение третьей степени по V, в которое давление Р входит в качестве параметра. Поскольку его коэффициенты вещественны, уравнение имеет либо один вещественный корень, либо три корня. Каждому корню на плоскости (V,P) соответствует точка, в которой изобара Р = const пересекает изотерму. В первом случае, когда корень один и точка пересечения будет одна.
Так будет, как мы видели, при любых давлениях, если температура достаточно высока. Изотерма имеет вид монотонно опускающейся кривой MN (рис.1).
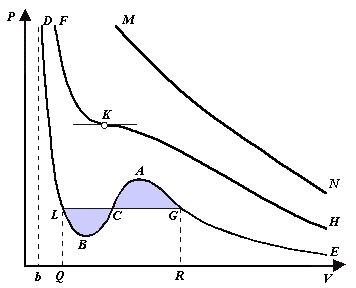
При более низких температурах и надлежащих значениях давления Р уравнение (6) имеет три корня V 1, V 2, V 3. В таких случаях изобара P = const пересекает изотерму в трех точках L, C, G (рис. 1). Изотерма содержит волнообразный участок LBCAG.
Она сначала монотонно опускается вниз (участок DB), затем на участке BA монотонно поднимается вверх, а за точкой A снова монотонно опускается. При некоторой промежуточной температуре три корня V 1, V 2, V 3 становятся равными. Такая температура и соответствующая ей изотерма называются критическими.
Критическая изотерма FKH всюду монотонно опускается вниз, за исключением одной точки K, являющейся точкой перегиба изотермы. В ней касательная к изотерме горизонтальна. Точка K называется критической точкой. Соответствующие ей давление Pk, объем Vk и температура Tk называются также критическими. Говорят, что вещество находится в критическом состоянии, если его объем и давление (а следовательно, и температура) равны критическим.
Для нахождения критических параметров Pk, Vk, Tk учтем, что в критической точке уравнение (6) переходит в уравнение
Поскольку в этом случае все три корня совпадают и равны Vk, уравнение должно приводиться к виду
Возводя в куб и сравнивая коэффициенты уравнений (7) и (8), получим три уравнения
Решая их, найдем выражения для параметров критического состояния вещества:
К тем же результатам можно прийти, заметив, что критическая точка К является точкой перегиба изотермы, касательная в которой горизонтальна, а поэтому в точке К должны соблюдаться соотношения
Решая эти уравнения совместно с уравнением изотермы (4) придем к формулам (9).
Не все состояния вещества, совместимые с уравнением Ван-дер-Ваальса, могут быть реализованы в действительности. Для этого необходимо еще, чтобы они были термодинамически устойчивы.
Одно из необходимых условий термодинамической устойчивости физически однородного вещества состоит в выполнении неравенства . Физически оно означает, что при изотермическом увеличении давления объем тела должен уменьшаться. Иными словами, при возрастании V все изотермы должны монотонно опускаться.
Между тем, ниже критической температуры на изотермах Ван-дер-Ваальса имеются поднимающиеся участки типа BCA (рис. 1). Точки, лежащие на таких участках, соответствуют неустойчивым состояниям вещества, которые практически реализованы быть не могут. При переходе к практическим изотермам эти участки должны быть выброшены.
Таким образом, реальная изотерма распадается на две ветви EGA и BLD, отделенные друг от друга. Естественно предположить, что этим двум ветвям соответствуют различные агрегатные состояния вещества. Ветвь EA характеризуется относительно большими значениями объема или малыми значениями плотности, она соответствует газообразному состоянию вещества.
Напротив, ветвь BD характеризуется относительно малыми объемами, а следовательно, большими плотностями, она соответствует жидкому состоянию вещества. Мы распространяем, следовательно, уравнение Ван-дер-Ваальса и на область жидкого состояния. Таким путем удается получить удовлетворительное качественное описание явления перехода газа в жидкость и обратно.
Возьмем достаточно разреженный газ при температуре ниже критической. Исходное состояние его на диаграмме PV изображается точкой E (рис. 1). Будем сжимать газ квазистатически, поддерживая температуру T постоянной. Тогда точка, изображающая состояние газа, будет перемещаться по изотерме вверх.
Можно было думать, что она достигает крайнего положения A, где изотерма обрывается. В действительности, однако, начиная с некоторой точки G, давление в системе перестает повышаться, и она распадается на две физически однородные части, или фазы: газообразную и жидкую.
Процесс изотермического сжатия такой двухфазной системы изображается участком GL горизонтальной прямой. При этом во время сжатия плотности жидкости и газа остаются неизменными и равными их значениям в точках L и G соответственно. По мере сжатия количество вещества в газообразной фазе непрерывно уменьшается, а в жидкой фазе — увеличивается, пока не будет достигнута точка L, в которой все вещество перейдет в жидкое состояние.
Такой ход изотерм впервые был обнаружен на опыте в конце XVIII века голландским ученым Ван Марумом (1750-1837). Ван Марум провел серию опытов с целью проверки закона Бойля-Мариотта. Одним из исследуемых газов был аммиак. С увеличением давления объем газа сначала уменьшался обратно пропорционально давлению, как того требовал закон Бойля-Мариотта.
Однако, когда давление достигло 7 атм, оно неожиданно перестало расти при дальнейшем сжатии, хотя объем и продолжал уменьшаться. При давлении 7 атм произошло сжижение газообразного аммиака. Начиная с этого момента. сжатие вещества приводило лишь к увеличению количества жидкого и уменьшению газообразного аммиака.
После Ван Марума последовали многочисленные попытки путем сжатия газов перевести их в жидкое состояние. Особенно больших успехов в этом направлении достиг Фарадей (1791-1867). Он применял комбинированный метод, сочетая сжатие газа с его охлаждением. Однако все эти исследования производились вслепую.
Оставалось неясно, почему при сжатии одних газов происходит сжижение, а других — нет. Влияние охлаждения и сама возможность сжижения газов не были ясны. Положение разъяснилось после классических работ английского физика Томаса Эндрюса (1813-1885), выполненных в течение 1861-1869 гг.
Эндрюс систематически исследовал ход изотерм углекислоты (СО2) при различных температурах и на основе этих исследований ввел понятие критической температуры. Углекислота им была выбрана сознательно, так как она обладает критической температурой (31 0 С), лишь незначительно превышающей комнатную, и сравнительно невысоким критическим давлением (72,9 атм). Оказалось, что при температуре выше 31 0 С изотермы углекислоты монотонно опускаются вниз, т.е. имеют гиперболический вид. Ниже этой температуры на изотермах углекислоты появляются горизонтальные участки, на которых изотермическое сжатие газа приводит к его конденсации, но не к увеличению давления. Таким путем было установлено, что сжатием газ можно превратить в жидкость только тогда, когда его температура ниже критической.
При специальных условиях могут быть реализованы состояния, изображаемые участками изотермы GA и BL. Эти состояния называются метастабильными. Участок GA изображает так называемый пересыщенный пар, участок BL — перегретую жидкость. Обе фазы обладают ограниченной устойчивостью.
Каждая из них может существовать до тех пор, пока она не граничит с другой более устойчивой фазой. Например, пересыщенный пар переходит в насыщенный, если в него ввести капли жидкости. Перегретая жидкость закипает, если в нее попадают пузырьки воздуха или пара.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Критические параметры (tк, pк, Vк) некоторых веществ
Многие вещества могут, в зависимости от внешних условий (температура, давление), находиться в трех агрегатных состояниях – твердом, жидком и газообразном.
газы не имеют постоянных объема и формы при постоянной температуре;
жидкости имеют постоянный объем, но форма зависит от сосуда;
твердые вещества имеют постоянную форму и объем.
Наиболее проста теория (и математическое описание) газового состояния. При “нормальных условиях” (0 о С или 273,15 К и 1 атм. или 101325 Па) большинство газов вполне удовлетворительно описываются уравнением состояния идеального газа (уравнение Клапейрона[[1]]-Менделеева):
Идеальный газ состоит из частиц (молекул), представляющих собой абсолютно твердые упругие шарики бесконечно малого размера, взаимодействием между которыми (кроме редких упругих столкновений) можно пренебречь. Для многих приблизительных расчетов и решения учебных задач используется следствие из закона Авогадро – при н.у. 1 моль газа (6,022 . 10 23 молекул) занимает объем, равный 22, 4 л.
Для реальных газов используют уравнения состояния с поправками, учитывающими собственный размер молекул и взаимодействие между ними. Во многих случаях достаточно приближенного уравнения Ван-дер-Ваальса [[2]]:
(p +a/V 2 )(V — b) = RT
a/V 2 – поправка, учитывающая взаимное притяжение молекул (“внутреннее давление”)
b – поправка, учитывающая собственный объем молекул и их взаимное отталкивание.
Реальные мольные объемы некоторых газов при н.у.:
| Водород | 22,428 л |
| Гелий | 22,424 л |
| Аммиак | 22,400 л |
| Азот | 22,408 л |
| Кислород | 22,392 л |
| Углекислый газ | 22,261 л |
| Хлороводород | 22,253 л |
Теория жидкостей разработана гораздо хуже, чем газов, поскольку свойства жидкостей зависят от геометрии и полярности взаимно близко расположенных молекул. Кроме того, отсутствие определенной структуры жидкостей затрудняет их формализованное описание – в большинстве учебников жидкостям уделено гораздо меньше места, чем газам и твердым кристаллическим веществам.
Между жидкостями и газами нет резкой границы – она полностью исчезает в критических точках. Для каждого газа известна температура, выше которой он не может быть жидким ни при каком давлении; при этой критической температуре исчезает граница (мениск) между жидкостью и ее насыщенным паром. Существование критической температуры (“температуры абсолютного кипения”) установил Д.И.Менделеев в 1860 г.
| Вещество | tк, о С | pк, атм | Vк, см 3 /моль | tплавл о С | tкип о С |
| He | -267,9 | 2,26 | 57,8 | -271,4 | -268,94 |
| H2 | -239,9 | 12,8 | 65,0 | -259,2 | -252,77 |
| N2 | -147,0 | 33,54 | 90,1 | -210,01 | -195,82 |
| O2 | -118,4 | 50,1 | -218,76 | -182,97 | |
| CH4 | -82,1 | 45,8 | 99,0 | -182,49 | -161,58 |
| CO2 | +31,0 | 72,9 | 94,0 | -56,16 | -78,48(субл) |
| NH3 | 132,3 | 111,3 | 72,5 | -77,76 | -33,43 |
| Cl2 | 144,0 | 76,1 | -101,0 | -34,06 | |
| SO2 | 157,5 | 77,8 | -75,48 | -10,02 | |
| H2O | 374,2 | 218,1 | 0,0 | 100,0 |
Твердые кристаллические вещества обладают упорядоченной структурой с повторяющимися элементами, что позволяет исследовать их методом дифракции рентгеновских лучей (метод рентгеноструктурного анализа, используется с 1912 г.) [[3]]. Твердые вещества плавятся при фиксированной температуре. Они достаточно подробно описаны в рекомендованных учебниках [[4]].
Стеклообразное состояние – твердое аморфное состояние вещества, которое получается в результате глубокого переохлаждения жидкости. Это состояние неравновесно, однако стекла могут существовать длительное время. Размягчение стекла происходит в некотором диапазоне температур – интервале стеклования, границы которого зависят от скорости охлаждения. С увеличением скорости охлаждения жидкости или пара возрастает вероятность получения данного вещества в стеклообразном состоянии. Стекла текут, хотя и очень медленно [[5]].
Лауреаты «шнобелевской» (Ig Nobel Prize (от английского ignoble — «постыдный», «позорный») — за самые бесполезные и абсурдные научные исследования и достижения.) премии 2005: ФИЗИКА: Премию получил Университет Квинсленда в Австралии, специалисты которого начиная с 1927 года ведут наблюдения за тем, как кусок смолы, которая теоретически является жидкостью, однако ведет себя как твердое вещество, капает через воронку – со скоростью одна капля каждые девять лет. Странно, что это единственное исследование данного типа сочли абсурдным.
В конце 60-х годов XX века получены аморфные металлы (металлические стекла) – для этого потребовалось охлаждать расплавленный металл со скоростью 10 6 — 10 8 град/с. Большинство аморфных металлов и сплавов кристаллизуются при нагреве свыше 300 о С. Одно из важнейших применений – микроэлектроника (диффузионные барьеры на границе металл-полупроводник) и магнитные накопители (головки ЖМД). Последнее – благодаря уникальной магнитомягкости (магнитная анизотропия меньше на два порядка, чем в обычных сплавах) [[6]].
Жидкокристаллическое состояние – промежуточное между кристаллическим и жидкостью. Жидкие кристаллы обладают одновременно текучестью и анизотропией (оптической, электрической, магнитной). Иногда это состояние называют мезоморфным (мезофазой) – из-за отсутствия дальнего порядка.
Особые качества жидких кристаллов были открыты австрийским ботаником Фридрихом Райницером в 1888 г. Прошло 85 лет, прежде чем их свойства нашли коммерческое применение. В 1973 г. японская компания Sharp Electronics выпустила первое изделие с ЖК-панелью: электронный калькулятор с цифровым дисплеем [[7]].
Верхний предел существования – температура просветления (изотропная жидкость).
Термотропные (мезогенные) ЖК существуют выше определенной температуры. Типичные – цианобифенилы.
Лиотропные – при растворении, например, водные растворы мыл, полипептидов, липидов, ДНК.

Рисунок 1. Структура смектических (а и б) и нематических (в) жидких кристаллов [[8]].
Рисунок 2. Структура дискотических жидких кристаллов:
а – колончатая фаза; б – нематическая фаза.
Смектические ЖК расположены слоями, нематические сохраняют только ориентацию при беспорядочном расположении центров тяжести молекул. Холестерические ЖК образуют слои, с поворотом слоев (ориентаций молекул) на определенный угол друг относительно друга.

Рисунок 3. Структура холестерических жидких кристаллов.
Жидкие кристаллы открыты в 1888 г. Ф.Рейнитцером и О.Леманом.
Студни – системы полимер-растворитель, характеризующиеся большими обратимыми деформациями при практически полном отсутствии вязкого течения. Иногда используют термин “ гели ”, который в коллоидной химии обозначает скоагулированные золи.
Наиболее важны студни на основе сетчатых полимеров с разной степенью поперечной сшитости.
При изменении температуры и давления возможен синерезис – отделение части жидкости.
Студни на основе сополимеров акриловой кислоты и акриламида используют для создания мембран с регулируемой проницаемостью, депо для лекарств в организме, в качестве сорбентов (в средствах гигиены) и как модели в биологических исследованиях [[9]]. Сильная адсорбция воды (несколько сотен граммов на грамм полимера) обусловлена наличием в геле свободных противоионов, которые не покидают его структуру из-за электростатического притяжения, но стремятся окружить себя многими слоями полярных молекул воды.
Если в системе есть реальные поверхности раздела, отделяющие друг от друга части системы, различающиеся по свойствам, то система называется гетерогенной (насыщенный раствор с осадком), если таких поверхностей нет, система называется гомогенной (истинный раствор). Гетерогенные системы содержат не менее двух фаз.
Фаза – совокупность всех гомогенных частей системы, одинаковых по составу и по всем физическим и химическим свойствам (не зависящим от количества вещества) и отграниченных от других частей системы поверхностью раздела. Внутри одной фазы свойства могут изменяться непрерывно, но на поверхности раздела между фазами свойства меняются скачком. Пример двухфазной системы – поверхность реки в ледоход.
Компонентами называют вещества, минимально необходимые для составления данной системы (минимум один). Число компонентов в системе равно числу веществ в ней присутствующих, минус число связывающих эти вещества независимых уравнений.
Компонентом называют вещество, которое может быть выделено из данной системы и количество которого можно менять (хотя бы в некоторых пределах) независимо от других.
Дисперсные системы – гетерогенные системы из двух или большего числа фаз с сильно развитой поверхностью раздела между ними. Одна из фаз образует непрерывную дисперсионную среду, в которой распределена дисперсная фаза в виде мелких кристаллов, твердых аморфных частиц, капель или пузырьков.
Грубодисперсные системы имеют размеры частиц выше 1 мкм, (удельная поверхность не более 1 м 2 /г), тонко(высоко)дисперсные или коллоидные системы содержат частицы от 1 нм до 1 мкм (удельная поверхность – сотни м 2 /г).
По агрегатному состоянию делят на:
газодисперсионные – аэрозоли (дымы, пыли, туманы), порошки, волокнистые материалы;
жидкодисперсионные с твердой дисперсной фазой – грубодисперсные суспензии и пасты, высокодисперсные золи и гели;
жидкодисперсионные с жидкой дисперсной фазой – грубодисперсные эмульсии, высокодисперсные эмульсии и латексы;
жидкодисперсионные с газовой дисперсной фазой – грубодисперсные газовые эмульсии и пены;
твердодисперсионные – например, рубиновые стекла, минералы типа опала, микропористые материалы.
Золи (нем. ед.ч. Sol) (лиозоли, коллоидные растворы) – высокодисперсные коллоидные системы с жидкой дисперсионной средой. Частицы дисперсной фазы золя вместе с окружающей их сольватной оболочкой из молекул (ионов) дисперсионной среды называют мицеллами. Размер частиц лиозоля в пределах 10 -7 – 10 -5 см.
Мицеллы лиофильных золей состоят из дифильных (например, состоящих из гидрофильной и гидрофобной части) молекул, которые находятся в термодинамическом равновесии с неассоциированными молекулами. Пример – мыло в воде.
Лиофобные золи неравновесны и требуют стабилизации. Пример мицеллы лиофобного золя бромида серебра:
Еще версия терминологии [[10]]:
Золь – коллоидно-дисперсная система с изолированными друг от друга, а гель – с соприкасающимися (агрессивными) коллоидными частицами; суспензия – грубодисперсная система с относительно малой, а паста – большой концентрацией дисперсной фазы.
Источник: studopedia.su